Atraktivní a bezpečné chemické pokusy propojené s RVP
Chemiluminiscence
Chemiluminiscence je jev, kdy dochází v důsledku chemické reakce k emisi studeného světla. Během chemiluminiscenční reakce vzniká z reaktantů reakční intermediát, který se nachází v energeticky bohatém, excitovaném stavu. Následný přechod této excitované molekuly do základního stavu je doprovázen vyzářením kvanta světelné energie. Detailněji je tento scénář vyobrazen na Obr. 1.

Látka A a B spolu reagují za vzniku produktů C* a D, z nichž produkt C* se nachází v excitovaném nebo jinak energeticky bohatém stavu. Produkt nebo přechodný intermediát C* se své přebytečné energie může zbavit vícero pochody:
- neproduktivní nezářivé přechody za vzniku tepla (nežádoucí proces)
- přímá deexcitace C* zářivým přechodem za emise světla charakteristické pro C*
- nepřímá deexcitace C* zářivým přechodem – C* svojí přebytečnou energii předá vhodné molekule fluoroforu, která ji dokáže pojmout a následně vyzářit. Emisní spektrum je pak závislé na struktuře fluoroforu.

Jak již bylo v úvodu zmíněno, nejznámější a první zdokumentovaný příklad chemiluminiscence, kterou cíleně vyvolal člověk, byl objev elementárního fosforu hamburským alchymistou H. Brandem (obr. 2). Zeleně svítící voskovitý bílý fosfor se při pokojové teplotě pomalu oxiduje na svém povrchu, přičemž vznikají v plynné fázi excitované meziprodukty (PO)2 a HPO, které jsou odpovědné za zelenou záři.
Poněkud nešťastně je pojem fosforescence spojován s oxidací fosforu, ačkoliv fosforescence je fenomén čistě fyzikálního původu, jak bylo vysvětleno již dříve.
Dnešní chemie zná celou řadu příkladů chemických reakcí, které poskytují chemiluminiscenci. Patří sem oxidace luminolu peroxidem vodíku, oxidace siloxenů, redukce RuIII komplexů tetrahydridoboritanovým aniontem, oxidace lofinu, lucigeninu, oxidace pyrogalolu peroxidem vodíku v přítomnosti formaldehydu, chemiluminiscence singletového kyslíku, nicméně zřejmě největšího komerčního rozšíření doznaly aktivované fenolické estery kyseliny šťavelové nejšířeji prozkoumané americkým výzkumníkem M. Rauhutem v šedesátých letech dvacátého století. Chemiluminiscenční reakce těchto esterů je využívaná v komerčních svítících lámacích tyčinkách.
Úspěch reakce esterů kyseliny šťavelové s peroxidem vodíku spočívá ve vysoké účinnosti, poměrně nízké ceně (v porovnání s ostatními systémy) a možnosti získat vhodnou volbou přidaného fluoroforu prakticky jakoukoliv barvu, od modré až po infračervenou. Bylo změřeno, že až 23% chemické energie těchto systémů se přeměňuje na světlo, což je nejvíce ze všech neenzymatických systémů.
Podíváme se chemiluminiscenci na zoubek z blízka
V literatuře nejznámější příklady fenolických esterů kyseliny šťavelové zahrnují estery nazývané DNPO (bis-(2,4-dinitrofenyl)oxalát) a TCPO (bis-(2,4,6-trichlorofenyl)oxalát). Tyto estery se běžně využívají v analytické chemii; jejich použití pro demonstraci ve školách je však nevhodné, protože jejich rozkladem vznikají silně jedovaté (2,4-dinitrofenol), popřípadě nepříjemně zapáchající fenoly (2,4,6-trichlorofenol).
Pozn.: V soupravách Chemie a světlo je dodávána pouze netoxická, příjemně vonící alternativa – di-vanillyl oxalát (DVO), ester kyseliny šťavelové a vanilinu, který má podobné chemické chování, ale postrádá tyto nevýhody.
Obecně přijímaný mechanismus této chemické reakce je popsán na Schématu 1:
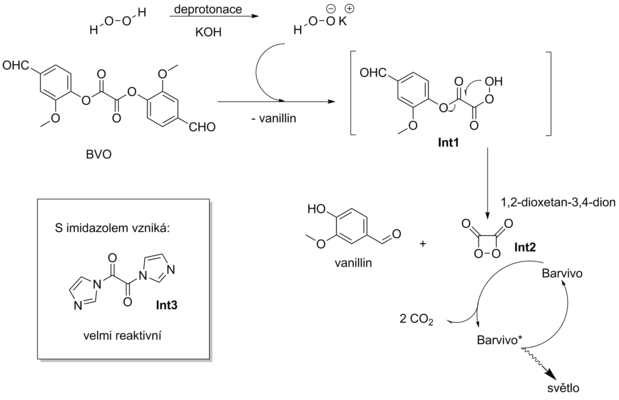
Peroxid vodíku je bází deprotonován na hydroperoxidový anion. Tento vyniká vyšší reaktivitou než samotný peroxid vodíku. Následně tento hydroperoxidový anion reaguje s DVO, v prvním kroku nastává odštěpení 1 molekuly vanillinu a vzniku polozreagovaného intermediátu Int1, který intramolekulární cyklizací odštěpuje další molekulu vanillinu a vzniká napjatý čtyřčlenný cyklus 1,2-dioxetan-3,4-dion (intermediát Int2). Tato látka je velmi nestabilní, vysoce energeticky bohatá a svoji energii předává molekule barviva, která pak vstupuje do excitovaného stavu a přitom se tento čtyřčlenný cyklus rozpadá na dvě molekuly CO2. Barvivo v excitovaném stavu deexcituje vyzářením fotonu.
Kromě báze, jako např. NaOH (případně octan sodný, octan draselný, apod.), katalyzují reakci i nukleofilní katalyzátory, jako je např. imidazol. Katalytický efekt imidazolu je dán jeho schopností převádět DVO na mnohem reaktivnější di-imidazolyl oxalát (intermediát Int3), jenž reaguje s peroxidem vodíku řádově rychleji.
Jak se nám toto hodí ve škole? Něco pro chemikáře
Peroxyoxalátová chemiluminiscenční reakce skýtá mnoho možností pro pedagogické využití. S její pomocí se dá demonstrovat celá řada chemických zákonitostí, jako jsou např. mezifázové transportní jevy, závislost reakční rychlosti na míchání, teplotě, přídavku katalyzátorů, apod.
Obecně platí, že měření i těch nejmenších množství světla je extrémně citlivé, proto lze pomocí chemiluminiscenčních reakcí měřit i stopová množství chemických látek. Využívají se v praxi hlavně pro analytické účely. V kriminalistice je známé využití reakce luminolu s peroxidem vodíku, která je katalyzovaná stopovým množstvím železa. Jelikož se železo nachází v krvi, je možné směsí luminolu a peroxidu vodíku detekovat i ty nejslabší skvrny po krvi.
Kromě možnosti měřit velmi nízké koncentrace peroxidu vodíku peroxyoxalátovou chemiluminiscencí je známo velké množství jiných reakcí využívaných v analytické chemii. Jeden takový příklad je stanovení obsahu oxidu dusnatého ve vzduchu reakcí s ozonem. Přesné a rychlé stanovení oxidu dusnatého je důležité pro monitorování stavu ovzduší.